Hibridisasi orbital
Dina kimia, hibridisasi ngandung harti nyampurna orbital atom jadi orbital anyar nu cocog pikeun beungkeutan. Hibridisasi mangrupa bagian integral tiori VSEPR, sarupa jeung modél mékanika kuantum pikeun éléktron orbital pikeun ngagambarkeun golongan 2,3,4 na tabel periodik unsur nu awan orbital éléktronna ngahiji jadi orbital hibrid. Golongan 1,5,6 jeung 7 na tabel periodik teu ngalaman hibridisasi. Tiori hibridisasi dikedalkeun ku kimiawan Linus Pauling pikeun ngadadarkeun ayana molekul kayaning métana (CH4). Masalah ayana métana nyaéta ku sabab métana dibentuk ku hiji atom karbon nu ngabeungkeut opat atom [[hidrogén. Konfigurasi bentuk asalna nyaéta 1s² 2s² 2px¹ 2py¹ atawa, supaya leuwih gampang dibaca:
(Catetan: orbital 1s énergina leuwih handap batan orbital 2s, sedengkeun énergi orbital 2s leuwih handap batan orbital 2p)
Tiori beungkeut valénsi bisa ngaduga-duga, dumasar ayana dua satengah-kaeusi orbital tipe p (dilambangkeun px py atawa pz teu nujul ka mamana di dieu mah, sabab teu ngeusi susunan nu puguh), yén C ngabentuk dua beungkeut kovalén. Ku kituna, CH2 katelah salaku gugus métiléna nu teu bisa kaluar tina sistim molekul, sahingga tiori ieu teu bisa ngécéskeun ayana CH4.
Leuwih jauh, orbital bentuk asal teu bisa dipaké pikeun beungkeutan na CH4. Najan ngaéksitasikeun éléktron 2s ka orbital 2p sacara téoritis ngawenangkeun opat beungkeut, dumasar tiori beungkeut valénsi nu geus dibuktikeun bener sacara ékspériméntal pikeun sistim kawas O2, ieu bisa jadi tanda yén rupa-rupa beungkeut na CH4 bakal mibanda énergi nu béda-béda alatan overlap orbital nu béda hambalanana. Sakali deui, ieu geus kabantah sacara ékspériméntal: sadaya hidrogén bisa dilaan tina karbonna kalawan énergi nu sarua.
Nepi ka dieu perlu diécéskeun deui yén orbital téh salawasna mangrupa modél, henteu nyata, nu diturunkeun tina kasaruaan Schrödinger. Pikeun hibridisasi, nyampurkeun orbital, cukup ku ngarobah fungsi matematik nu nangtukeun perenahna éléktron, nu teu mangaruhan struktur atomna.
Hambalan munggaran dina hibridisasi nyaéta éksitasi hiji (atawa leuwih) éléktron. Ti dieu urang contokeun baé métana nu basajan. Proton nu ngabentuk inti atom hidrogén metot salasahiji éléktron valénsi karbon. Ieu ngabalukarkeun éksitasi, mindahkeun éléktron 2s ka orbital 2p. Hal ieu, ngaronjatkeun pangaruh inti karbon na éléktron valénsi ku ngaronjatna poténsi akat éféktif (jumlah muatan inti dina ayana éléktron nu dipibanda = Muatan Akar - Muatan sakabéh éléktron nu deukeut ka inti).
Gabungan gaya-gaya ieu ngawujud jadi fungsi matematik anyar nu disebut orbital hibrid. Dina kasus karbon rék meungkeut opat atom hidrogén, butuh opat orbital. Ku kituna, orbital 2s (orbital akar ampir moal mungkin piiplueun dina beungkeutan) nyampur jeung tilu orbital 2p ngabentuk opat hibrid sp3 (dibaca s p tilu). Tempo ringkesanana di handap.
Peta ''parse'' gagal (Mun bisa MathML (uji coba): Respons tak sah ("Math extension cannot connect to Restbase.") dari peladen "http://localhost:6011/su.wikipedia.org/v1/":): {\displaystyle C^{*}\quad \frac{\uparrow\downarrow}{1s}\; \frac{\uparrow\,}{2s}\; \frac{\uparrow\,}{2p} \frac{\uparrow\,}{2p} \frac{\uparrow\,}{2p} } becomes
Dina CH4, opat orbital hibrid sp³ patumpang tindih jeung orbital 1s hidrogén, ngahasilkeun opat beungkeut sigma (σ). Opat beungkeut ieu mibanda panjang jeung kakuatan nu sarua.
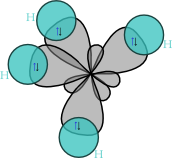 nu ditarjamahkeun jadi
nu ditarjamahkeun jadi  tétrahédral]] métana]]
tétrahédral]] métana]]
Sanyawa C jeung molekul lianna meureun bisa ogé digambarkeun sarupa kitu. Misalna éténa (C2H4). Karbon moal ngabentuk beungkeut kurang ti opat iwal mun euweuh pilihan séjén, nu kadang kajadian. Ku kituna, éténa mibanda dua beungkeut ganda karbon-karbonna. Struktur Lewis-na kawas kieu:

Karbon bakal ngahibrid sp2, sabab orbial hibrid ukur bakal ngabentuk beungkeut sigma jeung hiji beungkeut pi pikeun beungkeut kovalén antar karbonna. Beungkeut hidrogén-karbon mibanda kakuatan jeung panjang nu sarua, luyu jeung data ékspérimén.
Bentuk molekul
[édit | édit sumber]Hibridisasi ngabantu ngécéskeun bentuk molekul.
- AX2 (misalna, BeCl2): hibridisasi sp; bentuk liniér atawa digonal
- AX3 (misalna, BCl3): hibridisasi sp²; bentuk trigonal planar
- AX4 (misalna, CCl4): hibridisasi sp³; bentuk tétrahédral
- AX5 (misalna, PCl5): hibridisasisi sp³d; trigonal bipyramidal shape
- AX6 (eg, SF6): sp³d² hybridisation; octahedral (or square bipyramidal) shape


