Kolagén
Kolagén nyaéta salah sahiji protéin anu aya dina awak manusa. Jumlahna dina sakujur awak nepika 30%. Kolagén mangrupa hiji struktur organik pikeun ngawangun tulang, huntu, sendi, otot, jeun kulit. Ramat Kolagén mibanda daya tahan kuat tina pangaruh tekenan. Kolagén mimitina tina basa Yunani anu hartina (cepel atawa mibanda sipat cepel).[1]
Kolagén mangrupa protéin utama anu ngawangun otot jeung tulang, ogé méré kakuatan jeung daya tahan kulit. Kurangna produksi kolagén ngabalukarkeun kolagén dina kulit ngipisan. Kulit katempo péot jeung kendor. Di dieu pisan anu disebut ngolotan.[2][3]
Mangpaat Kolagén
[édit | édit sumber]Kolagén mibanda mangpaat anu gedé pikeun kalumangsungan hirup manusa Mangpaat Kolagén di antarana :[4]
- Ngahasilkeun asam amino umpamana prolin, glisin jeung lisin
- Ngajaga organ–organ anu penting dina jeroeun awak
- Ngajaga kulit supaya séhat, henteu garing jeung péot
- Ngajaga kulit supaya henteu garing
- Ngawangun otot, huntu, sendi, tulang jeung jeung kulit
- Ngajaga kasaimbangan métabolisme
- Ngajaga kaséhatana buuk jeung kuku awak
- Ngabantu ngalancarkeun getih
- Ngabantu nyerep kalsium
- Ngajaga ngarah awét ngora
- Jeung réa-réa deui.
Unsur pangwangun
[édit | édit sumber]Protéin kolagén diwangun tina triple helix , biasana kawangun tina dua kantétan anu sarua ( α1 ) jeung kantétan tambahan anu rada béda dina komposisi kimiana ( α2 ) . Komposisi asam amino kolagén nyaéta bahan pikeun ngawangun protéin, utamana dina kandungan hidroksiprolin anu kawilang loba. Paling umum asam amino kolagén nyaéta glisin - prolin - X jeung glisin - X - hidroksiprolin, di mana X nyaéta unggal asam amino séjén tina glisin, prolin atawa hidroksiprolin. Komposisi asam amino ieu rata-rata diperlukeun pikeun lauk jeung kulit mamalia .[5]
| Asam Amino | Aya dina kulit mamalia (Residu/1000) |
Aya dina kulit lauk (Residu/1000) |
|---|---|---|
| Glisin | 329 | 339 |
| Prolin | 126 | 108 |
| Alanin | 109 | 114 |
| Hidroxiprolin | 95 | 67 |
| Asam glutamat | 74 | 76 |
| Arginin | 49 | 52 |
| Asam aspartat | 47 | 47 |
| Serine | 36 | 46 |
| Lisin | 29 | 26 |
| Lleusin | 24 | 23 |
| Valine | 22 | 21 |
| Threonine | 19 | 26 |
| Fénilalanin | 13 | 14 |
| Isoleucine | 11 | 11 |
| Hidroxilisin | 6 | 8 |
| Methionine | 6 | 13 |
| Histidine | 5 | 7 |
| Tirosin | 3 | 3 |
| Sistéin | 1 | 1 |
| Triptofan | 0 | 0 |
Ciri Mandiri
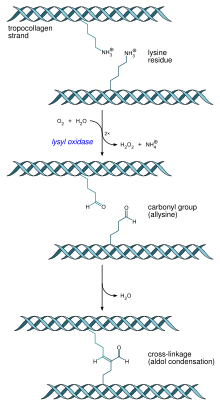
[édit | édit sumber]Kolagén mangrupa salah sahiji struktural serat. Ieu protéin mibanda kagunaan anu béda jeung protéin globular, saperti énzim. Beungkeutan kolagén anu kuat disebut serat kolagén, kalawan bahan utamana matrix extracellular paling ngarojong kana jaringan jeung méré struktur sél saluareunna. Kolagén ogé kapanggih di jeroeun sababaraha sél anu tangtu. Kolagén mibanda tensile kuat (henteu pegat dibetot) , sarta mangrupa komponén utama fascia , kartilage, ligamén, tendons, tulang jeung kulit.[6] Marengan keratin leuleus, tanggung jawabna ngajaga kakuatan kulit jeung élastisitasna [7][8]
Sajarah
[édit | édit sumber]Struktur jeung bungkus molekul kolagén geus mangpuluh-puluh taun jadi bahan panalungtikan para élmuwan. Buktina sajeroeun taun 1930-an dititénan yén kolagén mibanda struktur anu rapih dina molekulérna .[9][10] Ti saprak harita, para élmuwan, kasup anu kungsi dilélér nobel Crick, Pauling, aya ogé Yonath, jeung anu lain-na, sarta Brodsky, Berman, jeung Ramachandran, museurkeun panalungtikan kana monomér kolagén ieu. Sababaraha modél silih ganti pikeun mintonkeun hasilna, sanajan bener aya patalina jeung konfirmasi unggal ranté kantétan péptida individu, masih dibutuhkeun sababaraha bukti anu ngadukung pikeun nyampurnakeunna tapi sanajan kitu ieu geus meré jalan pikeun modél triple-heliks "Madras" Ramachandran, modél anu disadiakeun dasarna bener struktur kuaterner molekul [11][12][13]
Struktur rupa bungkus kolagén di luar acan dipuguhkeun sarua dina tingkat fibril kolagen, sanajan geus lila dipikawanoh mibanda heksagonal atawa kuasi-heksagonal.[14][15][16] Saperti struktur modél monomér kalawan ngébréhkeun, sababaraha anu ngajelaskeun susunan bungkus molekul kolagén nyaéta 'kawas lambaran' atawa microfibrillar.[17][18][19] Struktur microfibrillar fibril kolagen dina téndon, kornea jeung tulang rangu geus langsung diéceéskeun ku mikroskop éléktron.[20][21] Struktur microfibrillar buntut téndon, umpamana anu ditétélakeun ku Fraser, Miller, jeung Wess, digambarkeun ngajadi pangdeukeutna jeung struktur anu keur dititénan.[22] Sanajan dibasajankeun, kamajuan topologi tatangga molekul kolagen, jeung ku sabab éta henteu kasawang konfirmasi anu bener tina Pangatur D-periodik kapegat péntamérik disebut basajan: mikrofibril. Loba bagéan silang umpama L-Dopaquinone, embelin, kalium embelate jeung 5-O-metil embelin bisa dimekarkeun jadi bagéan silang atawa stabilisasi potensi kolagén jeung aplikasinya disadiakeun pikeunn lambar wound dressing dina aplikasi klinis .[23]
Tutumbu Kaluar
[édit | édit sumber]- Kolagen jeung Kaséhatan
- Kamus Kaséhatan-Ditempo 14 Séptémber 2015 Archived 2016-01-05 di Wayback Machine
Dicutat Tina
[édit | édit sumber]- ↑ Kolangen nyaéta
- ↑ Kamus Kaséhatan-Ditempo 14 Séptémber 2015 Archived 2016-01-05 di Wayback Machine
- ↑ Mangpaat kolagen
- ↑ [1]
- ↑ Szpak, Paul (2011). "Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis". Journal of Archaeological Science 38 (12): 3358–3372. doi:10.1016/j.jas.2011.07.022. https://www.academia.edu/801925/Fish_Bone_Chemistry_and_Ultrastructure_Implications_for_Taphonomy_and_Stable_Isotope_Analysis.
- ↑ Fratzl, P. (2008). Collagen: Structure and Mechanics. New York: Springer. ISBN 0-387-73905-X.
- ↑ Buehler, M. J. (2006). "Nature designs tough collagen: Explaining the nanostructure of collagen fibrils". PNAS 103 (33): 12285–12290. Bibcode 2006PNAS..10312285B. doi:10.1073/pnas.0603216103. PMC 1567872. PMID 16895989. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1567872.
- ↑ Zylberberg, L.; Laurin, M. (2011). "Analysis of fossil bone organic matrix by transmission electron microscopy". Comptes rendus Palevol 11 (5–6): 357–366. doi:10.1016/j.crpv.2011.04.004.
- ↑ Wyckoff, R.; Corey, R. & Biscoe, J. (1935). "X-ray reflections of long spacing from tendon". Science 82 (2121): 175–176. Bibcode 1935Sci....82..175W. doi:10.1126/science.82.2121.175. PMID 17810172.
- ↑ Clark, G.; Parker, E.; Schaad, J. & Warren, W. J. (1935). "New measurements of previously unknown large interplanar spacings in natural materials". J. Amer. Chem. Soc 57 (8): 1509. doi:10.1021/ja01311a504.
- ↑ Balasubramanian, D . (October 2001). "GNR — A Tribute". Resonance (Indian Academy of Sciences) 6 (10). http://www.ias.ac.in/resonance/php/toc.php?vol=06&issue=10.
- ↑ Leonidas, Demetres D.; Chavali, GB; Jardine, AM; Li, S; Shapiro, R; Acharya, KR (2001). "Binding of Phosphate and pyrophosphate ions at the active site of human angiogenin as revealed by X-ray crystallography". Protein Science 10 (8): 1669–1676. doi:10.1110/ps.13601. PMC 2374093. PMID 11468363. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=2374093.
- ↑ Subramanian, Easwara (2001). "Obituary: G.N. Ramachandran". Nature Structural & Molecular Biology 8 (6): 489–491. doi:10.1038/88544. PMID 11373614.
- ↑ Okuyama, K.; Okuyama, K; Arnott, S; Takayanagi, M; Kakudo, M (1981). "Crystal and molecular structure of a collagen-like polypeptide (Pro-Pro-Gly)10". J Mol Biol 152 (2): 427–443. doi:10.1016/0022-2836(81)90252-7. PMID 7328660.
- ↑ Traub, W.; Yonath, A. & Segal, D. M. (1969). "On the molecular structure of collagen". Nature 221 (5184): 914–917. Bibcode 1969Natur.221..914T. doi:10.1038/221914a0.
- ↑ Bella, J.; Eaton, M.; Brodsky, B.; Berman, H. M. (1994). "Crystal and molecular structure of a collagen-like peptide at 1.9 A resolution". Science 266 (5182): 75–81. Bibcode 1994Sci...266...75B. doi:10.1126/science.7695699. PMID 7695699.
- ↑ Hulmes, D. J. & Miller, A. (1979). "Quasi-hexagonal molecular packing in collagen fibrils". Nature 282 (5741): 878–880. Bibcode 1979Natur.282..878H. doi:10.1038/282878a0. PMID 514368.
- ↑ Jesior, J. C.; Miller, A. & Berthet-Colominas, C. (1980). "Crystalline three-dimensional packing is general characteristic of type I collagen fibrils". FEBS Lett 113 (2): 238–240. doi:10.1016/0014-5793(80)80600-4. PMID 7389896.
- ↑ Fraser, R. D. B. & MacRae, T. P. (1981). "Unit cell and molecular connectivity in tendon collagen". Int. J. Biol. Macromol. 3 (3): 193–200. doi:10.1016/0141-8130(81)90063-5.
- ↑ Fraser, R. D.; MacRae, T. P.; Miller, A. (1987). "Molecular packing in type I collagen fibrils". J Mol Biol 193 (1): 115–125. doi:10.1016/0022-2836(87)90631-0. PMID 3586015.
- ↑ Wess, T. J.; Hammersley, AP; Wess, L; Miller, A (1998). "Molecular packing of type I collagen in tendon". J Mol Biol 275 (2): 255–267. doi:10.1006/jmbi.1997.1449. PMID 9466908.
- ↑ Holmes, D. F.; Gilpin, C. J.; Baldock, C.; Ziese, U.; Koster, A. J.; Kadler, K. E. (2001). "Corneal collagen fibril structure in three dimensions: Structural insights into fibril assembly, mechanical properties, and tissue organization". PNAS 98 (13): 7307–7312. Bibcode 2001PNAS...98.7307H. doi:10.1073/pnas.111150598. PMC 34664. PMID 11390960. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=34664.
- ↑ Narayanaswamy, Radhakrishnan; Shanmugasamy, Sangeetha; Shanmugasamy, Sangeetha; Gopal, Ramesh; Mandal, Asit (2011). "Bioinformatics in crosslinking chemistry of collagen with selective crosslinkers". BMC 4: 399. doi:10.1186/1756-0500-4-399.
| Artikel ieu mangrupa taratas, perlu disampurnakeun. Upami sadérék uninga langkung paos perkawis ieu, dihaturan kanggo ngalengkepan. |
